Pada tahun 1928, Wolfgang Pauli (1900-1958) mengemukakan bahwa tidak ada dua elektron dalam satu atom yang boleh mempunyai keempat bilangan kuantum yang sama. Orbital yang sama akan mempunyai bilangan kuantum n, l, m yang sama. Dengan demikian, yang dapat membedakan hanya bilangan kuantum spin (s). Setiap orbital hanya dapat berisi 2 elektron dengan spin (arah putar) yang berlawanan.
Dengan adanya larangan Pauli ini, maka elektron yang dapat menempati suatu subkulit terbatas hanya dua kali dari jumlah orbitalnya. Jumlah maksimum elektron adalah sebagai berikut :
 Silahkan perhatikan beberapa contoh dibawah ini :
Silahkan perhatikan beberapa contoh dibawah ini :
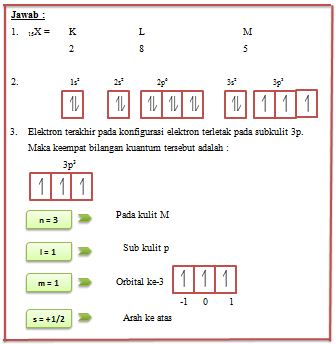
Suatu atom unsur memiliki nomor atom 15. Tentukan :
- Konfigurasi elektron berdasarkan uraian kelas 1
- Gambaran orbital dari konfigurasi elektron yang telah anda buat
- Ke empat bilangan kuantum dari elektron terakhir pada konfigurasi elektron
Apakah anda mengerti mengenai penjelasan di atas ? jika anda belum mengerti silahkan baca materi di atas sekali lagy ^_^
Konfigurasi elektron dari gas mulia dapat dipergunakan untuk menyingkat konfigurasi elektron dari atom-atom yang mempunyai jumlah elektron (bernomor atom) besar.
perhatiakan cara menyingkat berikut ini :
Penyingkatan ini memberikan kemudahan di dalam menentukan elektron valensi dan diagram orbital dari suatu atom. Elektron valensi dan diagram orbital ini akan sangat berguna dalam mempelajari ikatan kimia.
Anda telah mempelajari Asas Aufbau, Kaidah Hund dan Larangan Pauli, selanjutnya anda dapat mencoba latihan soal untuk mengetes kemampuan anda, check this out !!!!!
jika anda berhasil menyelesaikan latihan soal dengan baik, silahkan lanjut ke materi selanjutnya yaitu Golongan dan Periodik.
Semangaaaaattttt 🙂 tidak ada keberhasilan tanpa perjuangan kawan 🙂