ERWIN SCHRODINGER
Erwin Schrodinger menerapkan matematika untuk menjelaskan pola gelombang partikel yang bergerak, terutama diterapkan pada gerakan elektron atom hidrogen. Matematika terapan yang disusun oleh Schrodinger tersebut selajutnya dikenal sebagai Mekanika Kuantum.
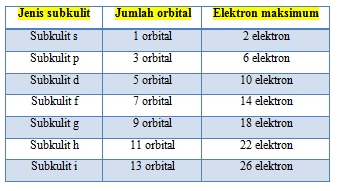
Satu kulit tersusun dari subkulit-subkulit
Satu subkulit tersusun dari orbital-orbital
Satu orbital menampung maksimal dua elektron
Tabel 1. Hubungan Subkulit, Orbital, dan Jumlah Elektron Maksimum
Orbital-orbital dalam satu subkulit mempunyai tingkat energi yang sama, sedangkan orbital-orbital dari subkulit berbeda, tetapi dari kulit yang sama mempunyai tingkat energi yang bermiripan
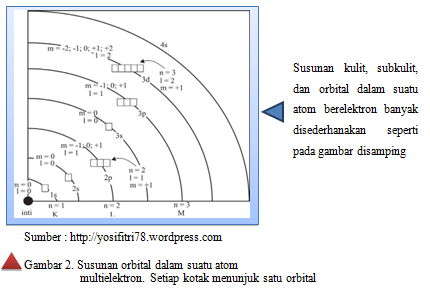
Penyelesaian persamaan gelombang dari Erwin Schrodinger menghasilkan tiga bilangan yang mencirikan orbital elektron. Ketiga bilangan ini disebut dengan Bilangan Kuantum, yang terdiri dari bilangan kuantum utama, bilangan kuantum azimuth dan bilangan kuantum magnetik.
Untuk mempelajari bilangan kuantum silahkan lanjut ke