Untuk menyatakan distribusi elektron-elektron pada orbital-orbital dalam suatu subkulit, konfigurasi elektron dapat dituliskan dalam bentuk diagram orbital. Dua elektron yang menghuni satu orbital dilambangkan dengan dua anak panah yang berlawanan arah. Jika orbital hanya mengandung satu elektron, anak panah dituliskan mengarah ke atas.
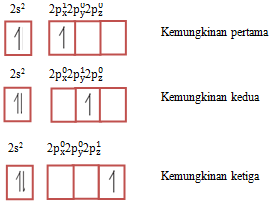
Setiap subkulit (kecuali subkulit s) tersusun atas beberapa orbital dengan energi setingkat, dengan demikian elektron dimungkinkan menempati orbital mana saja. Sebagai contoh : pada atom 5B dengan konfigurasi 1s2 2s2 2p1, sebuah elektron yang terdapat pada subkulit p dapat menempati orbital px, py, atau pz, sebab ketiganya mempunyai tingkat energi yang sama. Ketiga kemungkinan tersebut dapat digambarkan diagram orbitalnya sebagai berikut :
5B = [He] 2s2 2p1 diagram orbitalnya adalah :
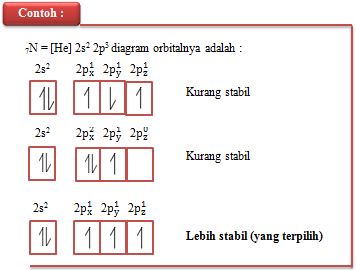
Menurut Friedrich Hund (1927), seorang ahli fisika dari Jerman mengemukakan aturan pengisian elektron pada orbital yaitu :
“ orbital-orbital dengan energi yang sama, masing-masing diisi lebih dulu oleh satu elektron arah (spin) yang sama atau setelah semua orbital masing-masing terisi satu elektron kemudian elektron akan memasuki orbital-orbital secara urut dengan arah (spin) berlawanan”
Berdasarkan pendapat Friedrich Hund keadaan yang paling rendah energinya (paling stabil) adalah bila elektron-elektron tersebut tersebar ke semua orbital dengan spin yang sejajar (spin sama), aturan ini dikenal dengan Aturan Hund.
Sudah mengertikah anda?
Jika belum ulangi membaca dari awal,
Jika sudah silahkan lanjut ke materi selanjutnya ^_^



Saya masih belum paham tentang pengisian spin